Es el estudio de la geometría molecular de una manera mas estructural y arquitectónica de la materia con ènfasis en la estructura molecular de las sustancias orgànicas
Una molecula es un agregado por lo menos de dos atomos con una distribucion definida que se mantienes unidas por fuerzas especiales.
Y se clasifican de la siguiente manera:
1)Molecula diatómica: es la molecula formada por dos atomos.
2)Molécula diatómica homonuclear: es la molecula diatómica que contiene átomos del mismo elemento.
3)Molecula no polar: es la molecula que no tiene un momento dipolar.
4)Molecula polar: es la molecula que tiene un momento polar.
5)Molecula poliatomica: es la molecula formada por mas de dos átomos
Geometría molecular angular
En Química, la geometría molecular angular (también llamada en forma de V) describe la disposición de los electrones en el espacio en torno a aquellas moléculas de tipo AX2E1 o AX2E2, según la VSEPR,
es decir, aquellas moléculas con dos pares de electrones enlazantes y
uno o dos pares no enlazantes. Debido a la existencia de numerosas
moléculas con una de estas dos estructuras electrónicas, este tipo de
geometría es predominante.
Geometría del agua
El ejemplo más conocido es el de la molécula de agua (H2O).
En ella, los pares de electrones sin compartir ejercen una repulsión
que evita la formación de un tetraedro (109,5º), por lo que los enlaces
O-H forman entre sí un ángulo de 104,5º. A nivel analítico, se puede
predecir que los pares electrónicos formen 90º debido a la configuración
electrónica del oxígeno (1s22s2p4),
sin embargo resulta evidente la existencia de una repulsión mutua entre
los propios átomos de hidrógeno, que "abren" el ángulo de enlace hasta
que la fuerza de repulsión de los pares no enlazantes lo permiten.
De esta forma, se observa como la geometría molecular angular deriva de la geometría molecular tetraédrica,
en tanto que las moléculas angulares tienen tan solo dos pares de
electrones enlazantes, mientras que las tetraédricas tienen sus únicos
cuatro pares enlazados, formando ángulos de 109,5º.
Geometría molecular tetraédrica
Estructura ideal de una molécula teraédrica con un átomo central de color rosa.
El metano (CH 4 ) es una molécula tetraédrica, con ángulos de enlace de 109º
La geometría molecular tetraédrica es un tipo de geometría molecular en la que un átomo central se encuentra en el centro enlazado químicamente con cuatro sustituyentes que se encuentran en las esquinas de un tetraedro. Algunos ejemplos de especies químicas con esta geometría son el metano (CH4), el ion amonio (NH4+), o los aniones sulfato (SO42-) y fosfato (PO43-).
Ángulos de enlace y simetría
Los ángulos de enlace cumplen la condición cos σ = −1/3
por lo que σ = cos−1(−1/3) y por tanto σ ≈ 109,5°, cuando los cuatro sustituyentes son iguales, como en el CH4. Esta geometría molecular es común en todos los elementos químicos de la primera mitad de la tabla periódica. El tetraedro perfectamente simétrico pertenece al grupo puntual Td,
pero la mayoría de las moléculas tetraédricas no poseen tan alta
simetría porque los cuatro sustituyentes no son iguales. Las moléculas
tetraédricas puede ser quirales si poseen los cuatro sustituyentes diferentes.
Ejemplos
Elementos representativos
La práctica totalidad de los compuestos orgánicos saturados, y la mayoría de los compuestos de Si, Ge, y Sn son tetraédricos. A menudo, las moléculas tetraédricas muestran enlaces múltiples a ligandos exteriores, como en tetróxido de xenón (XeO4), el ion perclorato (ClO4-), el ion sulfato (SO42-) o el ion fosfato (PO43-). El trifluoruro de tiazilo, SNF3 es tetraédrico, con un triple enlace azufre-nitrógeno.
El amoníaco (NH3) puede ser clasificado como tetraédrico, si se tiene en cuenta el par solitario como un ligando como en el lenguaje de la teoría RPECV, pero es más conveniente considerar la molécula como piramidal trigonal. Los ángulos H-N-H son 107°, algo menores del valor teórico 109,4°, una diferencia atribuida a la influencia del par solitario.
Metales de transición
Nuevamente, la geometría está muy extendida, particularmente para los complejos en los que el metal tiene configuración d0 o d10. Ejemplos ilustrativos son el tetraquis(trifenilfosfina)paladio (0), el carbonilo de níquel y el tetracloruro de titanio. Muchos complejos con niveles d incompletos son a menudo tetraédricos, por ejemplo, los tetrahaluros de hierro (II), cobalto (II) y níquel (II).
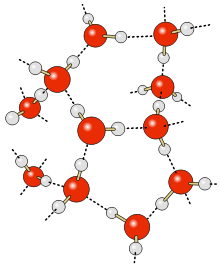
Estructura del agua
Moléculas de agua líquida mostrando geometría de tetraedro irregular.
La configuración más común de las moléculas de agua líquida es tetraédrica con dos átomos de hidrógeno unidos covalentemente al oxígeno y otros dos hidrógenos unidos por enlaces de hidrógeno.
Ya que los enlaces de hidrógeno varían en longitud muchas de estas
moléculas de agua no son simétricas y forma tetraedros irregulares
transitorios entre sus cuatro átomos de hidrógeno asociados. Cuando la molécula de agua está aislada (estado gaseoso) presenta geometría angular.
Excepciones y distorsiones
La inversión de los tetraedros se presenta con frecuencia en química
orgánica y en compuestos de los elementos representativos. La llamada inversión de Walden ilustra las consecuencias estereoquímicas de la inversión en el carbono. La inversión del nitrógeno en el amoniaco también implica la formación transitoria de moléculas NH3 planas.
Geometría tetraédrica invertida
Las restricciones geométricas en una molécula puede causar una grave
distorsión de la geometría tetraédrica ideal. En los compuestos con
"carbono invertido", por ejemplo, el carbono es piramidal.
Los ejemplos más simples de moléculas orgánicas mostrando carbono invertido son los propelanos más pequeños, por ejemplo, el [1.1.1]propelano, o en general, o más en general los paddlanos, y piramidanos. Estas moléculas poseen típicamente tensión estructural, lo que da como resultado una mayor reactividad.
Planarización
Un tetraedro también puede aparecer distorsionado por el aumento del
ángulo entre dos de los enlaces. En el caso extremo, se produce un
aplanamiento de la molécula. Entre los compuestos de carbono, este
fenómeno se puede observar en una clase de compuestos llamados fenestranos.
Geometría molecular piramidal cuadrada
Estructura idealizada de un compuesto de coordinación con una geometría molecular piramidal cuadrada
En química, la geometría molecular piramidal cuadrada describe la forma o geometría molecular de ciertos compuestos de fórmula química ML5, donde M es un átomo central y L es un ligando. Si los átomos del ligando estuviesen conectados, la forma resultante sería la de una pirámide de base cuadrada.
Características
Esta geometría es común en ciertos compuestos en los que el átomo central es un elemento representativo que tiene un par solitario estereoquímicamente activo, tal como se describe en teoría RPECV. Ciertos compuestos cristalizan tanto con geometría de bipirámide trigonal como formando estructuras piramidales cuadradas, en particular, [Ni(CN)5]3&minus.1
Como estado de transición en la pseudorotación de Berry
Cuando una molécula bipiramidal trigonal sufre una pseudorotación de Berry,
pasa a través de una etapa intermedia con geometría cuadrada plana.
Así, a pesar de que esa geometría se ve rara vez en moléculas en estado
fundamental, podemos encontrarla como resultado de una distorsión de
baja energía a partir de una bipirámide trigonal.
La pseudorotación también se da en moléculas piramidales cuadradas.
Las moléculas con esta geometría, a diferencia de la bipiramidal
trigonal, presentan una vibración más fuerte. El mecanismo utilizado es
similar al mecanismo de Berry.
Ejemplos
Algunos compuestos moleculares que adoptan la geometría piramidal cuadrada son XeOF4, y XF5 (X = Cl, Br, I). Los complejos de vanadio (IV), como por ejemplo [VO(acac)2] son piramidales cuadrados (acac=acetilacetonato, un anion derivado de la 2,4-pentanodiona que ha perdido un protón).















No hay comentarios:
Publicar un comentario