































 En
realidad lo que hemos visto es la manera como una fuerza de enlace ( iónico en
este caso del NaCl) se manifiesta cuando dos átomos de naturaleza muy distinta
reaccionan para formar una molécula con cargas muy diferentes. Sin embargo,
también cabe preguntarse, ¿cómo se manifiesta la fuerza de un enlace entre
átomos idénticos, en los que no existe separación de carga? Para responder esta
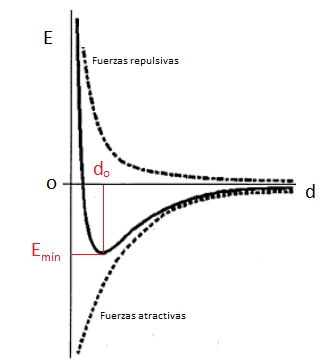
pregunta, fijémonos en la formación de una molécula H2 como lo señala la
figura. Así, cuando los átomos se acercan, electrostáticamente van a existir
dos términos desfavorables (repulsión entre dos núcleos de carga (+) y entre
dos electrones de carga (-) ) y un término favorable grande (atracción de cada
electrón por ambos núcleos de H ). Para saber del predominio de estos términos,
cuál es más fuerte por ejemplo, recordemos que en la naturaleza existe el
principio que cualquier sistema, al formarse deberá alcanzar su menor estado de
energía posible. Así un enlace se formará sólo si los dos átomos H separados
tienen una mayor energía que los átomos unidos. Experimental y teóricamente
para la molécula H2 , esto es así y la distancia de separación del mínimo de la
curva es la que se conoce como distancia de enlace
En
realidad lo que hemos visto es la manera como una fuerza de enlace ( iónico en
este caso del NaCl) se manifiesta cuando dos átomos de naturaleza muy distinta
reaccionan para formar una molécula con cargas muy diferentes. Sin embargo,
también cabe preguntarse, ¿cómo se manifiesta la fuerza de un enlace entre
átomos idénticos, en los que no existe separación de carga? Para responder esta
pregunta, fijémonos en la formación de una molécula H2 como lo señala la
figura. Así, cuando los átomos se acercan, electrostáticamente van a existir
dos términos desfavorables (repulsión entre dos núcleos de carga (+) y entre
dos electrones de carga (-) ) y un término favorable grande (atracción de cada
electrón por ambos núcleos de H ). Para saber del predominio de estos términos,
cuál es más fuerte por ejemplo, recordemos que en la naturaleza existe el
principio que cualquier sistema, al formarse deberá alcanzar su menor estado de
energía posible. Así un enlace se formará sólo si los dos átomos H separados
tienen una mayor energía que los átomos unidos. Experimental y teóricamente
para la molécula H2 , esto es así y la distancia de separación del mínimo de la
curva es la que se conoce como distancia de enlace
Obviamente este valor es característico para cada
molécula y existirán tantas distancias como posibilidades de formación de
moléculas sea posible. Además, en el caso de H2, en que
de acuerdo a lo mostrado en la figura, los electrones se encuentran con mucha
probabilidad a lo largo de la línea de unión, se dirá que los e- 's son
compartidos por los núcleos de la molécula formando así un enlace covalente.
También existen enlaces no covalentes o
parcialmente covalentes en los casos de moléculas formadas por átomos
diferentes ( H-X por ejemplo), dependiendo esta clasificación de la diferencias
de electronegatividad entre los átomos constituyentes (por ejemplo, entre H y
X) como lo señala el cuadro a continuación.Energía de enlace
Cuando se forma un enlace químico
se desprende energía. Por el contrario, si deseamos romper el enlace
formado, debemos aportar externamente esa misma cantidad de energía.
Así, se define la energía de enlace como la energía liberada cuando se forma un mol de enlaces a partir de los átomos en estado gaseoso y fundamental. A estas energías de enlace se las llama también entalpías de enlace, como veremos en el tema de termoquímica.
Cabe destacar que cuanto mayor es la
energía desprendida en la formación de un enlace más energía se requiere
para romperlo y, por tanto, más estable es.
Longitud de enlace o distancia internuclear
La longitud de enlace es la distancia de equilibrio entre los núcleos atómicos, el valor del valle en la curva de estabilidad energética. Esta distancia internuclear es medible experimentalmente por técnicas espectroscópicas o de difracción.
Es preciso indicar, no obstante, que los valores de las tablas solo son promedios, ya que los átomos no permanecen fijos en el espacio,
sino que se hallan vibrando en torno a una posición de equilibrio. Cabe
añadir, además, que si tenemos enlaces múltiples, aumenta la energía de enlace y disminuye la distancia de enlace.
Ángulo de enlace
El ángulo de enlace
sólo tiene sentido cuando consideramos 3 átomos, y es el ángulo formado
por los ejes imaginarios que unen el núcleo del átomo central con los
núcleos de los átomos unidos a él.
En cuanto a la polaridad del enlace, dada su importancia, lo trataremos con profundidad en el apartado “Polaridad del enlace y polaridad molecular”.
No hay comentarios:
Publicar un comentario